Sceptic-Ratio. Властивості рідини
Властивості рідини
Щільність рідини ρ визначається як відношення маси Δ m до зайнятого нею об'єму ΔΩ (в СІ вимірюється в кг / м³):
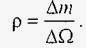
У довільній точці рідини щільність визначається межею:
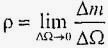 .
.
Щільність залежить від температури і тиску; зокрема, залежність щільності води від її температури при нормальному атмосферному тиску показана в табл. 1.
Таблиця 1 t ° С ρ кг / м³ t ° С ρ кг / м³ 0 999,87 30 995,76 2 999,97 35 994,13 4 1000,0 40 992,35 6 999,97 50 988,20 8 999 , 88 60 983,38 10 999,75 70 977,94 15 999,15 80 971,94 20 998,26 90 965,56 25 997,12 100 958,65Властивість рідин змінювати свій обсяг при зміні тиску називається сжимаемостью. Вона характеризується коефіцієнтом об'ємного стиснення βΩ, який являє собою відносну зміну об'єму рідини ΔΩ / Ω при збільшенні тиску на одиницю Δ P:
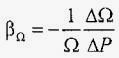 ;
;
Тиск і напруга в СІ вимірюється в паскалях (Па): 1 Па = 1 Н / м² = 10 дин / см = 0,0075 мм рт. ст. Далі ми часто будемо використовувати одиницю виміру атмосфера (атм): 1 атм = 101325 Па = 760 мм рт. ст. Це - так звана фізична атмосфера, яка відрізняється від технічної, яку часто позначають тільки двома буквами - ат: 1 ат = 735,56 мм рт. ст. = 98066,5 Па. Коефіцієнт βΩ вимірюється в 1 / Па. Знак «-» в останній формулі вказує на те, що при збільшенні тиску обсяг рідини буде зменшуватися.
При незмінній масі (m = const), маємо рівність:
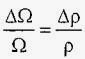 ;
;
отже, при зміні тиску на одиницю Δ P коефіцієнт об'ємного стиснення можна визначити також через відносну зміну щільності рідини:
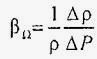 .
.
Величина, зворотна коефіцієнту об'ємного стиснення, називається модулем пружності рідини (вимірюється в Па):
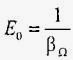 або
або 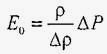 (*).
(*).
Звідки випливає закон Гука для рідин в умовах всебічного стиснення.
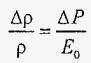 .
.
Величина модуля пружності Е 0 залежить від температури і тиску, тому рідини не обов'язково діятимуть за законом Гука. У табл. 2 дані значення модуля пружності води при різній її температурі (справедливо для тисків - від нормального до 50 атм).
Таблиця 2 t ° С Е 0 ГПа 0 999,87 10 999,97 20 1000,0 30 999,97Для практиків наведемо кілька важливих характеристик. Модуль пружності мінеральних масел, використовуваних в механізмах з гідравлічним приводом, при t = 20 ° С становить 1,35 - 1,75 ГПа (менше значення відноситься до більш легкому маслу), бензину і гасу - приблизно 1,3 ГПа, гліцерину - 4 , 4 ГПа, ртуті - в середньому 3,2 ГПа. Розчини, що застосовуються при бурінні, мають Е 0 = 2,5 ГПа.
Стисливість води незначна: при збільшенні тиску на 9,81 МПа обсяг води зменшується всього на 0,0005% початкового об'єму. Тому воду часто вважають нестисливої середовищем. При цьому не слід забувати, що таке припущення правомірно лише в тих випадках, коли зміни тиску невеликі. У практиці експлуатації гідравлічних систем відзначаються випадки, коли внаслідок дії того чи іншого обурення (наприклад, різке закриття або відкриття запірного пристрою в трубопроводі) в рідини значно змінюється тиск. У таких випадках нехтування сжимаемостью рідини призводить до істотних погрішностей.
Все пізнається в порівнянні. Вірно, що стисливість води невелика, проте вона приблизно в 100 разів більше стисливості стали. Нехтування сжимаемостью води може призвести до парадоксу. Справді, оскільки в безмежній однорідної рідини або в обсязі, обмеженому абсолютно жорсткими стінками, швидкість поширення звуку визначається виразом:
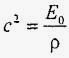 ,
,
то з урахуванням виразу (*) отримуємо наступне співвідношення для зміни щільності при зміні тиску:
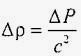 ,
,
Якщо в цьому виразі допустити, що рідина абсолютно нестислива, тобто Δρ → 0, то швидкість звуку в рідині виявиться нескінченно великою величиною: c → ∞, що не відповідає дійсності. Швидкість звуку в воді величезна, але кінцева. Вона дорівнює приблизно 1,5 км / с (див. Табл. 3 розділу Введення в акустику ).
Властивість рідин змінювати обсяг при зміні температури характеризується температурним коефіцієнтом об'ємного розширення - β t, який вимірюється 1 / K або 1 / ° С. При постійному тиску цей коефіцієнт показує відносну зміну об'єму рідини при зміні температури на 1 ° С:
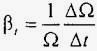 .
.
Щільність рідини при нагріванні в результаті збільшення її обсягу зменшується. Це зменшення виражається через коефіцієнт об'ємного розширення β t за такою формулою:
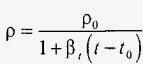 .
.
де ρ0 - щільність рідини при температурі t 0. Коефіцієнт β t зі збільшенням тиску для більшості рідин також зменшується. Але для води ця залежність виглядає складніше. Про непростому зміні коефіцієнта β t від температури і тиску дає уявлення табл. 3, де наведені середні значення коефіцієнта об'ємного розширення для води (в одиницях 1 / K) при трьох довільних (P = 1, 100 і 500 атм) і в п'яти температурних діапазонах, зазначених в першому стовпчику таблиці.
Таблиця 3 t ° С P = 1 P = 100 P = 500 1-10 0,140 0,430 1,490 10-20 0,150 0,165 0,236 40-50 0,420 0,422 0,429 60-70 0,556 0,548 0,523 90-100 0,719 - 0,661Як бачимо, в діапазоні температур 10-20 ° C спостерігається різке зниження коефіцієнта β t, але з ростом тиску абсолютна величина цього провалу все ж стає менше.
У табл. 4 наведені значення β t для деяких рідин при кімнатній температурі t = 20 ° С і нормальному атмосферному тиску (P = 1 атм).
Таблиця 4 βt 1 / K Рідина 0,15 Вода 0,18 Ртуть 0,50 Гліцерин 0,60 Нафта 1,10 СпиртУ практичному плані важливо пам'ятати, що при звичайному зменшенні щільності нафтопродуктів (з 920 до 700 кг / м³) коефіцієнт β t збільшується дуже незначно. Тому для робочих рідин в гідросистемах коефіцієнт β t зазвичай приймають не залежних від температури. Для таких рідин зростання тиску від атмосферного до 60 МПа призводить до збільшення коефіцієнта β t приблизно на 10 - 20%, причому чим вище температура робочої рідини, то більша збільшення коефіцієнта β t.
Переходимо до наступної важливу характеристику рідини - в'язкості. Під нею розуміється властивість рідини чинити опір відносному зсуву її шарів. В'язкість виникає завдяки міжмолекулярної взаємодії, що іноді називають просто тертям молекул усередині рідини або внутрішнім тертям. Тертя між молекулами (шарами) і, тим самим в'язкість рідини, можна легко уявити на прикладі наступної математичної моделі.
У деяких розрахунках в'язкість рідини можна не враховувати. У цьому випадку рідина називають ідеальною. Якщо розглядати протягом цієї ідеальної рідини всередині циліндричної труби, то швидкості всіх її молекул в перерізі AB будуть однаковими (рис. 1, зліва). Розподіл швидкостей молекул для реальної рідини, коли враховується її в'язкість, являє собою параболу (рис. 1, справа). У точках A і B швидкість молекул дорівнює нулю; по осі циліндра в центрі труби вона виявиться максимальною.
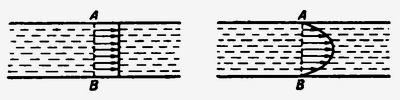
Мал. 1. Швидкості розподілу молекул
для ідеальної (зліва) і реальною (праворуч) рідин
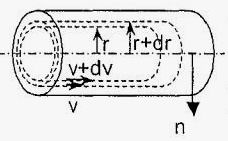
Мал. 2. Шарувату рух рідини в трубі (зліва);
деформація елементарного шару рідини (праворуч)
Відповідно до рис. 2, маємо наступне співвідношення:
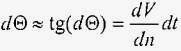 ,
,
де величина dV / dn є градієнт швидкості по нормалі до осі потоку. При шаруватому русі швидкість деформації зсуву дорівнює градієнту швидкості:
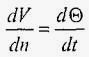 .
.
Тоді дотичне напруження визначається за формулою
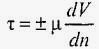 ,
,
де μ - коефіцієнт динамічної в'язкості рідини. Залежно від вибору напрямку відліку відстаней по нормалі (від стінки даної труби або від її осі) градієнт швидкості може бути позитивним (відстань відраховується від стінки) або негативним (відстань відраховується від осі труби). Знак у формулі приймається таким, щоб дотичне напруження було позитивним. В'язкість рідин вимірюють за допомогою віскозиметрів різних типів і конструкцій.
У природних умовах і в промисловому виробництві існує велика різноманітність в'язкопластичних середовищ: бетонні гідросуміші, будівельні розчини, розчини полімерів, колоїдні суспензії, гідросуміші з глини, мулів, крейди, цементу і т.д. У таких випадках до дотичному напруженню τ може додаватися якась відчутна поправка τ0:
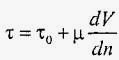 ,
,
Таким чином, ці рідини навіть у стані спокою (dV / dn = 0) володіють ненульовим значенням дотичного напруження.
Динамічна в'язкість μ залежить від температури і тиску рідини. Для чистої води залежність динамічної в'язкості від температури, запропонована Ж. Пуазейля (1799 - 1869), має вигляд
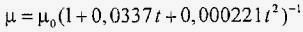 ,
,
де t - температура, змінюється в межах від 0 до 90 ° С; μ0 - динамічна в'язкість при t = 0 ° С; коефіцієнт μ вимірюється в одиницях Па · с. На згадку французького вченого одиниця динамічної в'язкості була названа пуаз (П). В системі СГС 1 П = 1 г / (см · с). Одиниця динамічної в'язкості в СІ: Па · с; 1 Па · с = 10 П.
У табл. 5 наведені значення динамічної в'язкості води при різній температурі.
Таблиця 5 t ° С μ мПа · с t ° С μ мПа · с 0 1,78 40 0,66 5 1,52 50 0,55 10 1,31 60 0,47 15 1,14 70 0,41 20 1 , 01 80 0,36 30 0,80 90 0,32Крім динамічної в'язкості в розрахунках використовується кінематична в'язкість, що дорівнює відношенню динамічної в'язкості до щільності рідини:
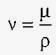 ,
,
де щільність рідини (ρ) можна виразити через конкретні значення температури (T) і тиску (P):
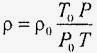 ,
,
Тут індекс «0» відноситься до нормальних атмосферних умов. Назва «кінематична в'язкість» відображає той факт, що в розмірність величини ν входять тільки кінематичні, але не динамічні, величини. В СІ одиниця кінематичної в'язкості - м² / с. Застосовується також і позасистемна одиниця стокс (Ст), названа на честь англійського фізика Джорджа Габріеля Стокса (1819 - 1903), який довгі роки займався гідродинаміки. 1 Ст = 1 см² / с = 10-4 м² / с. У табл. 6 наведені значення кінематичної в'язкості для деяких речовин.
Таблиця 6 Речовина t ° С ν Ст Повітря 0 0,133 Нафта легка 18 0,250 Нафта важка 18 1,400 Гас 15 0,027 Мазут 18 20,00 Масло АМГ-10 50 0,100 Сталь рідка 1550 0,0037 Ртуть 15 0,0011Кінематична в'язкість води, яка містить певну кількість дрібних (менше 0,05 мм) суспендованих твердих частинок, може помітно збільшуватися в порівнянні з чистою водою. Так, при t = 5 ° C і кількості зважених часток 100 мг / л кінематична в'язкість ν = 1,6 · 10-6 м² / с, а при забрудненні в 600 мг / л ν = 2,0 · 10-6 м² / с. Але при нагріванні води концентрація суспензії впливає слабо. Наприклад, при t = 25 ° C і тій же кількості зважених часток 100 мг / л ν = 0,90 · 10-6 м² / с, а при забрудненні в 600 мг / л ν = 0,92 · 10-6 м² / с.
Всі рідини в тій чи іншій мірі поглинають і розчиняють гази. Відповідно до закону розчинності Дальтона, при тисках до 30 МПа і постійній температурі відносний обсяг розчиненого газу в рідині (Ωг / Ωж) дорівнює постійній величині kp, званої коефіцієнтом розчинності газу або константою Генрі. Коефіцієнт розчинності залежить від температури:
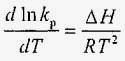 ,
,
де Δ H - зміна ентальпії при розчиненні, R - універсальна газова стала.
Процес переходу рідини в газоподібний стан, що відбувається всередині рідини, називається кипінням. Рідина можна довести до кипіння підвищенням температури до значень, великих температури кипіння при даному тиску, або зниженням тиску до значень, менших тиску насичених парів рідини при даній температурі. Зазвичай при зниженні тиску до тиску насичених парів рідини (при даній температурі) в рідині утворюються бульбашки, заповнені парами рідини або газами, що виділилися з рідини, тобто відбувається так зване холодне кипіння. При наявності в рідині вільної поверхні ці бульбашки спливають і виходять назовні. У табл. 7 приведена залежність тиску насичених парів води (P нп) від температури при нормальному зовнішньому атмосферному тиску.
Таблиця 7 t ° С Pнп кПа t ° С Pнп кПа 5 0,87 30 4,30 10 1,23 40 7,40 15 1,70 60 20,3 20 2,33 80 48,3 25 3,20 100 103 , 3У тому випадку, коли крапельна рідина знаходиться в замкнутому просторі і не має вільної поверхні, ці бульбашки можуть, переміщаючись разом з рідиною, потрапити в область більш низької температури або більш високого тиску. Тоді пари газів конденсуються, гази знову розчиняються в рідині, в порожнечі, що утворилися проникають частинки рідини, що призводить до різкого хляпанню бульбашок. В результаті цього відбувається підвищення тиску і локальне підвищення температури. Таке явище називається кавітацією. Через безперервного імпульсивного впливу і підвищення температури в процесі кавітації відбувається більш активне руйнування поверхні стінок посудини або трубопроводу.
Гази можуть перебувати в рідини в розчиненому і нерастворенном вигляді. Присутність в рідині нерозчиненого повітря (або іншого газу) у вигляді бульбашок істотно зменшує модуль пружності рідини, причому це зменшення не залежить від розмірів бульбашок. У рідини, з якої видалений розчинений і не розчинений газ, тобто в дегазованої рідини, кипіння настає при температурі більшій температури кипіння. У звичайних умовах великі маси рідини не чинять опір розтіканню або розтягуючих зусиль, але в дегазованих рідинах це опір виникає. Для малих мас рідини вступають в дію так звані сили поверхневі натягу.
Молекули рідини, що знаходяться на кордоні з газом, твердим тілом або між двома несмешивающимися рідинами, відчувають з боку інших молекул рідини не врівноважене ззовні вплив. Під впливом цього впливу поверхню рідини прагне прийняти форму, відповідну найменшою площі. В результаті цього малі маси рідини, утворюючи в повітрі краплі (туману або дощу), прагнуть до кулястої формі.
Щоб збільшити поверхню рідини, необхідно частину внутрішніх молекул вивести на поверхню, для чого доведеться зробити роботу. Це можна уявити як наявність опору розтягуванню поверхні рідини, тобто на поверхні рідини розподілені сили, що перешкоджають розтягуванню. Ці сили, що діють по дотичних до поверхні, власне, і називаються силами поверхневого натягу.
Зі збільшенням температури поверхневий натяг σ зменшується. Вода в контакті з повітрям при температурі 20 ° C і нормальному атмосферному тиску створює поверхневу напругу σ = 0,0726 Н / м. Для етилового спирту ця величина дорівнює 0,022; для різних мастил - 0,035 - 0,038; для ртуті - 0,486. Якщо ртуть стикається ні з повітрям, а з водою, то при тій же температурі 20 ° C поверхневий натяг на межі двох рідин зменшується і дорівнює 0,378 Н / м.
В трубках малого діаметра - капілярах - спостерігається викривлення вільної поверхні, що межує з газом або з парами цієї ж рідини. Якщо поверхню трубки змочується, вільна поверхня рідини в капілярі стає увігнутою; якщо змочування немає, то вільна поверхня - випукла. В обох випадках сили поверхневого натягу обумовлюють додаткові (капілярні) напруги, які змушують рідина або підніматися вздовж вертикального капіляра (при змочуванні), або опускатися (якщо змочування відсутня). Величина підйому або зниження стовпа рідини (h кап) в капілярі діаметром d визначається за формулою Жюрена:
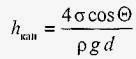 ,
,
де σ - поверхнева напруга, ρ - щільність рідини, g - прискорення вільного падіння, Θ - крайовий кут змочування (гострий кут між дотичною до вільної поверхні в точці перетину зі стінкою і самої стінкою капіляра).
Для чистої води і скла Θ ≈ 0 °; при t = 20 ° C вода піднімається на висоту h кап = 30 / d, якщо d виражається в мм. В капілярних термометрах як робоча речовина використовується спирт і ртуть. Для них висота підняття рідини дорівнює, відповідно, 11,5 / d і 10,15 / d, причому кут Θ близький до 45 °. Підняття води в капілярах грунту є важливим фактором її подачі до коріння рослин. У глині грунтова вода може піднятися на 5 метрів. Гравій капіляри не утворює, тому трава і дерева на ньому не ростуть. Зі збільшенням мінералізації води зростає і висота її капілярного підняття.
У порівнянні з іншими рідинами вода має низку унікальних властивостей. Чиста вода, в цілому будучи нейтральною речовиною, часто виступає сильним розчинником. Ця її здатність характеризується відносною діелектричною проникністю, яка досить висока і для дистильованої води: при 0 ° С вона складає близько 87. З ростом температури діелектрична проникність зменшується до 55,7 при 100 ° С.
Для порівняння зазначимо, що у більшості інших розчинників діелектрична проникність значно нижче і змінюється в межах від 10 до 50. У так званих неполярних рідин, що не володіють здатністю розчиняти електроліти, вона становить 2-2,5. Таким чином, у порівнянні з повітрям, діелектрична проникність якого дорівнює 1, ця характеристика води набагато більше (для льоду вона дорівнює 3,2).
Через присутність у воді розчиненого повітря, багатого киснем, і ряду агресивних компонентів молекули води розщеплюються на кислотні (H +) і лужні (OH -) компоненти, що призводить до електрохімічної корозії матеріалів. Розчинені у воді солі і зважені в ній тверді частинки можуть призвести до заростання стінок трубопроводу непотрібними відкладеннями, через які пропускна здатність його помітно знижується.
Електропровідність сухого льоду и снігу набагато менше електропровідності води, причому електропровідність води сильно Залежить від наявності домішок, а на електропровідність льоду смороду вплівають мало. Електропровідність води Залежить від концентрації розчіненіх у ній солей. Тому електропровідність морської води на 2-3 порядки вище, ніж електропровідність прісної річкової води, і більше приблизно в 12 тисяч разів, ніж електропровідність хімічно чистої води (при 18 ° С).
Вода має аномально велику питому теплоємність - 4,18 Дж / (кг · K). Ця величина 5 разів більше, ніж у вапняку, в 9 разів більше, ніж у заліза і в 33 рази більше, ніж у ртуті. Таким чином, вода в озері при однаковій температурі повітря і однаковому вихідному нею сонячному теплі нагріється в 5 разів менше, ніж сухий піщаний пляж на березі озера. Однак у стільки ж разів вода буде довше зберігати отримане тепло, ніж піщаний грунт. Океани забезпечують інерційність природних коливань клімату на Землі. Добре відомо, що поблизу морів клімат набагато м'якше, ніж усередині континентів.
Вода має також високою теплотою випаровування (22,6 · 105 Дж / кг) і прихованої теплотою плавлення (3,34 · 105 Дж / кг). Для переходу води в пару при атмосферному тиску з навколишнього середовища потрібно в 6,75 рази більше теплоти, ніж при плавленні льоду при тому ж тиску. При конденсації вологи (освіту туману) виділяється значна кількість теплоти. Це використовується в установках, що створюють штучний туман. Такі установки крім зрошення можуть використовуватися для запобігання рослин від заморозків.
Якщо при плавленні твердих тіл теплоємність речовини змінюється незначно, то при плавленні льоду вона збільшується стрибком більш ніж удвічі - від 2,052 до 4,224 кДж / кг. При нагріванні теплоємність води спочатку падає, досягаючи мінімуму 4,1809 кДж / кг при температурі 34,5 ° C (нагадаємо, нормальна температура людського тіла дорівнює 36,6 ° C), а потім починає знову збільшується. Поява цього мінімуму пояснюється повним руйнуванням кластерів - особливих асоціативних груп з молекул води, показані на рис. 3.
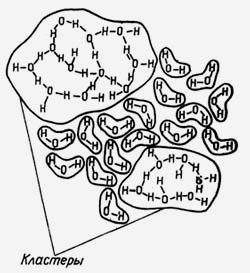
Мал. 3. У так званій талій воді молекули H2O можуть
об'єднуватися в складні асоціації - кластери,
за структурою нагадують лід.




