поверхнево активні речовини
ПОВЕРХНЕВО-АКТІВНИЕВЕЩЕСТВА - (ПАР) - речовини (як правило, органічного. З'єднання), що володіють високою поверхневою активністю, т. Е. Здатністю адсорбуватися на міжфазних межах і сильно знижувати поверхневий натяг. Мірою поверхневої активності може служити значення похідної 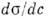 при з
при з  0, де
0, де 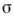 - поверхневий натяг, з - об'ємна концентрація ПАР. В принципі будь-яка речовина в певних умовах може проявити поверхневу активність. В особливий клас ПАР виділяються речовини, що мають високу поверхневу активність на кордонах водного розчину.
- поверхневий натяг, з - об'ємна концентрація ПАР. В принципі будь-яка речовина в певних умовах може проявити поверхневу активність. В особливий клас ПАР виділяються речовини, що мають високу поверхневу активність на кордонах водного розчину.
Поверхнева активність обумовлена будовою молекул ПАР: вони дифільної, т. Е. Містять одночасно гидрофильную (полярну) і гідрофобну (ліпофільную) атомні групи (див. Гідрофільність і гідрофобност'). Як гідрофільних можуть виступати функціональні групи спиртів (- ОН), кислот (- СООН, - S03H, - S04H і ін.) І їх солей, амінів (- ГШ2) і ін. Групи. Ліпофільні групи зазвичай представлені вуглеводневими або фторуглеродного радикалами.
Одна молекула ПАР може містити дек. груп обох видів. Для того щоб ПАР збиралося переважно. на кордоні фаз (а не всередині однієї з них), гідрофільна і липофильная частини молекули повинні бути енергетично збалансовані. Відповідна кількостей. характеристика - число гідрофільно-ліпофільного балансу (ГЛБ) за шкалою Гріффіна - Девіса задається співвідношенням ГЛБ = 7 + 0,36 W / kT, де W - робота перенесення 1 молекули ПАР з полярної в неполярну фазу (зазвичай з води в рідкий вуглеводень). Для більшості ПАР числа ГЛБ знаходяться в інтервалі 0 - 40. Малі числа ГЛБ відповідають маслорастворімих, великі - водорозчинних ПАР. Числа ГЛБ мають властивість адитивності по відношенню до отд. групам молекули ПАР. Є таблиці групових чисел, по яких швидко розраховується число ГЛБ для будь-якого з'єднання. Число ГЛБ визначає призначення і ефективність дії ПАР.
Наїб. важливою класифікацією ПАР є класифікація по іоногенні властивостями гідрофільних груп: 1) аніонні (апіонактівние) ПАР, здатні диссоциировать в полярному розчиннику з утворенням поверхнево-активних аніонів - солі карбонових кислот (в т. ч. мила), алкілсульфати, алкилсульфонати, алкіларплсульфонати, фторуглеродниє сульфонати та ін .; 2) катіонні (катіонеактівние) ПАР, здатні диссоциировать з утворенням поверхнево-активних катіонів (похідні алкіламіпов і ін.); 3) амфотерні (амфолітні) ПАР, містять дек. полярних груп і дають при дисоціації, в залежності від величини рН у водному розчині поверхнево-активні аніони або катіони; 4) цвіттер-іонні ПАР, в нейтральних полярних групах яких брало протилежні заряди істотно розділені в просторі ін. Структурними елементами молекули [напр., Бетаїн складу RN + (CH2C6H5) (GH3) СН2СОО-, де R - алкіл з числом атомів вуглецю 8 - 12); 5) неіонні (неіоногенні) ПАР з протяжної полярної групою - поліоксіетіленовой ефіри аліфатіч. спиртів і кислот, алкилфенолов, амінів і ін. з'єднань. Перші 3 типу часто об'єднуються під загальним назв. іонних (йоногенних) ПАР. Наїб. поширені аніонні та неіонні ПАР. Поверхнево-активні речовини також діляться на низько- і високомолекулярні (з периодич. Розташуванням гідрофільних і ліпофільних груп в лінійної полімерної ланцюга), масло і водорозчинні, колоїдні (міцеллообразующие, їх відрізняє оптимальна величина ГЛБ) і неколлоідние. Др. напрямок класифікації - за призначенням ПАР. Розрізняють емульгатори (ГЛБ 3,5 - 6 і 8 - 18), смачиватели (7 - 9), миючі агенти (детергенти, 13 - 15), солюбілізатори (15 - 18) і т. Д.
Адсорбція ПАР при малій об'ємній концентрації носить мономолекулярний характер (див. мономолекулярний шар ) І супроводжується виникненням поверхневого тиску . кінетика адсорбції визначається швидкістю дифузії і для деяких ПАР специфічний. енергетичних. бар'єром адсорбції, пов'язаним з молекулярною будовою ПАР. Рівноважна мономолекулярна адсорбція одного ПАР описується рівнянням Ленгмюра 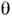 = Kc / (1 + kc), де
= Kc / (1 + kc), де 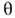 - ступінь заповнення моношару, з - концентрація ПАР в об'ємній фазі, k - постійна для даної речовини величина. На міжфазній межі молекули ПАР розташовуються так, що гідрофільна група залишається в фазі, що складається з полярних молекул. При адсорбції з водних розчинів велику роль відіграє гідрофобний ефект - прагнення води до ліквідації внутр. порожнин і виштовхування гідрофобних тіл, обумовлене міжмолекулярним взаємодією і структурою води. Завдяки гідрофобним ефекту ліпофільні вуглеводневі або фторуглеродниє ланцюга молекул ПАР виштовхуються з водного розчину в повітря, сусідню рідку фазу з неполярних молекул або притискаються до поверхні твердого тіла. На кордоні розчин - повітря ланцюга орієнтуються при малих
- ступінь заповнення моношару, з - концентрація ПАР в об'ємній фазі, k - постійна для даної речовини величина. На міжфазній межі молекули ПАР розташовуються так, що гідрофільна група залишається в фазі, що складається з полярних молекул. При адсорбції з водних розчинів велику роль відіграє гідрофобний ефект - прагнення води до ліквідації внутр. порожнин і виштовхування гідрофобних тіл, обумовлене міжмолекулярним взаємодією і структурою води. Завдяки гідрофобним ефекту ліпофільні вуглеводневі або фторуглеродниє ланцюга молекул ПАР виштовхуються з водного розчину в повітря, сусідню рідку фазу з неполярних молекул або притискаються до поверхні твердого тіла. На кордоні розчин - повітря ланцюга орієнтуються при малих 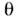 горизонтально, при великих - вертикально.
горизонтально, при великих - вертикально.
Міцели ПАР - молекулярні або іонні агрегати розміром ок. 3 - 100 нм, що виникають в розчинах колоїдних ПАР після досягнення критичного. концентрації міцелоутворення. Міцелярні розчини ПАР мають специфічний. властивостями. Перехід до міцелоутворення відбувається у вузькому інтервалі концентрацій, і його можна трактувати як фазовий перехід 2-го роду. Причиною міцеллообразованія у водних розчинах є гідрофобний ефект, а в середовищах з неполярних молекул - взаємне притягання полярних груп молекул ПАР. При наближенні концентрації ПАР до критичного. концентрації міцелоутворення відбувається різка зміна властивостей розчину: електропровідності, поверхневого натягу, коеф. розсіювання світла, осмотіч. тиску, коеф. дифузії і т. д. Нижче певної темп-ри (точки Крафта) освіту мицелл не відбувається, а при збільшенні концентрації ПАР спостерігається кристалізація. Крива рівноваги міцелярного розчину з твердою фазою на діаграмі стану зв. кордоном Крафта. Її верхня межа відповідає нижній темп-ре існування рідких кристалів, освіту яких брало характерно для концентрпров. розчинів ПАР. Для мицелл характерний поліморфізм: при підвищенні концентрації ПАР форма міцел переходить від сферичної до циліндричної (стержпеобразной), а потім - до пластинчастої (дископодібної).
Міцелярні розчини можуть розчиняти речовини, малорозчинні в даному розчиннику, цей процес наз. Солюбілізація. Він складається в проникненні молекул розчинної речовини в міцели. Солюбілізація може відбуватися не тільки з сусідньої фази, але і з власної. адсорбційного шару розчину. На цьому заснований метод виявлення в ПАР поверхнево-активних домішок: нижче критичного. концентрації міцелоутворення вони у великій концентрації знаходяться в адсорбционном шарі і поверхневий натяг падає зі збільшенням концентрації розчину, вище цієї концентрації - переходять в міцели і поверхневий натяг зростає. Т. о., Наявність мінімуму на изотерме поверхневого натягу розчину ПАР свідчить про домішки в ПАР.
ПАР надають стабілізуючу дію в емульсіях і ін. Дисперсних системах (суспензіях, пенах).
Застосування ПАР різноманітне і продовжує розширюватися. ПАР використовуються як миючі засоби, інгібітори корозії, смачиватели, плівкоутворювачів, піноутворювачі, піногасники, емульгатори, диспергатори, регулятори росту кристалів. Відомі застосування ПАР в процесах флотації, для підвищення віддачі нафтових пластів, збірки нафти, боротьби з вугільним пилом, гасіння хвиль і турбулентності, уповільнення випаровування водойм, додання водовідштовхувальних властивостей ґрунтів, цементів і ін. Матеріалами. Добавки ПАР підвищують якість будує. матеріалів, мастил та металорізального інструменту. ПАР необхідні для виробництва хім., Харчових, лікарських емульсій, пен (пожежних пен, пінопластів, пенобетонов і т. П.), Аерозолів та ін.
Літ.: Абрамзон А. А., поверхнево-активні речовини, 2 вид., Л., 1981; Русанов А. І., Левич С. А., Жаров В. Т., Поверхневе поділ речовин, Л., 1981.
А. І. Русанов.
покажчик >>




