Електросинтез
Електрос і нтез (від електро ... і синтез ), Метод отримання складних неорганічних або органічних сполук за допомогою електролізу . Характерна особливість Е. - многостадийность приєднання або віддачі електронів, пов'язана з утворенням проміжних стабільних або нестабільних продуктів. Кожній стадії Е. відповідає певне значення електродного потенціалу .
Багатостадійні процеси Е. можуть бути виражені за допомогою наступних рівнянь:
R + nH ++ ne- ® RH k + (n - k) Н + + (n - k) e- ® RH k + r + (n- k- r) Н + + (n - k - r) е - ® RH n, (1)
R '+ nOH - - ne- ® R'O k + (n - k) OH- + k H + + (n - k) е-® R'O k + r + (n - k - r) OH- + (k + r) H + - (n - k - r) e - ® R'O n + nH +, (2)
де R і R '- вихідні продукти; RHn і R'On - кінцеві продукти; n, k, r - число електронів (е -), що беруть участь в електрохімічних реакціях.
Реакції, що виражаються рівнянням (1), протікають на катоді і називаються реакціями електровідновлення, або електрохімічного відновлення. Реакції, що виражаються рівнянням (2), протікають на аноді і називаються реакціями електроокислення, або електрохімічного окислення. Проміжні та кінцеві продукти можуть брати участь в різних електрохімічних реакціях на поверхні електродів.
Якщо цільовий продукт Е. утворюється на проміжній стадії, то електроліз необхідно проводити при контрольованому електродному потенціал, відповідному цій стадії. Продукт можна швидко виводити зі сфери реакції шляхом відгону, екстракції або зв'язування в з'єднання, що не вступає в електрохімічні перетворення. Вихід продукту Е. може змінюватися і в результаті різних хімічних реакцій в об'ємі розчину за участю проміжних, вихідних і кінцевих речовин. Наприклад, деякі окислювачі, одержувані на аноді, можуть розкладатися в об'ємі розчину з втратою активного кисню, гидролизоваться, діспропорціоніровать і т. Д. Роль хімічних реакцій в об'ємі розчину враховується по об'ємної щільності струму, або концентрації струму. Ця величина визначається як сила струму, що проходить через одиницю об'єму електроліту, і виражається в а / л. Процеси Е., в яких хімічні реакції в об'ємі розчину призводять до зменшення виходу цільового продукту, повинні проводитися з високими об'ємними плотностями струму (до декількох сотень а / л).
З найбільшою ефективністю електровосстанавліваются або електроокісляются вихідні речовини, диссоційовані в розчині на іони, а також органічні сполуки, що мають полярні функціональні групи. Нейтральні молекули органічних речовин у багатьох випадках не володіють достатньою реакційною здатністю і не вступають в реакції на поверхні електрода. У цьому випадку застосовуються методи непрямого електровідновлення або електроокислення, здійснювані в об'ємі розчину за допомогою каталізаторів-переносників, в якості яких використовуються іони металів або неметалів змінної валентності. Процес в загальному вигляді може бути описаний наступними рівняннями:
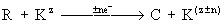 - хімічна реакція,
- хімічна реакція,
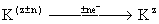 -Електрохіміческая реакція, де R - вихідний продукт, К - каталізатор-переносник, С - кінцевий продукт, z - ступінь окислення, n - число електронів (е -), що беруть участь в реакції.
-Електрохіміческая реакція, де R - вихідний продукт, К - каталізатор-переносник, С - кінцевий продукт, z - ступінь окислення, n - число електронів (е -), що беруть участь в реакції.
Роль електролізу в даному випадку зводиться до регенерації на електродах хімічного відновника або окислювача, які при взаємодії з вихідною речовиною в електролізі або поза ним перетворюють цю речовину в цільовий продукт.
Е. знаходить практичне застосування для отримання ряду цінних неорганічних і органічних сполук. Шляхом електроокислення синтезують, наприклад, кисень з'єднання хлору в різних ступенях окислення.
У промисловості застосовують спосіб отримання надсірчані (пероксодісерной) кислоти і її солей - персульфат (див. пероксосульфати ), Заснований на електроокислення сірчаної кислоти і сульфатів. Надсерная кислота і частина її солей використовуються при виробництві перекису водню. Перманганат калію отримують електроокислення манганата або анодним розчиненням сплавів марганцю з залізом - феромарганцю. Двоокис марганцю в значних масштабах проводиться електролізом сірчанокислих розчинів сульфату марганцю.
Е. застосовується і при отриманні різних органічних сполук (див. Кольбе реакція ).
Електрохімічне фторування використовується для промислового отримання ряду перфторсорганіческіх з'єднань. Електрохімічним методом отримують тетраетилсвинець і багато інших речовин.
Літ .: Прикладна електрохімія, під ред. А. Л. Ротіняна, 3 вид., Л., 1974; Фіошін М. Я., Успіхи в області електросинтезу неорганічних сполук, М., 1974; Прикладна електрохімія, під ред. Н. Т. Кудрявцева, 2 вид., М., 1975; Морив А. П., Фіошін М. Я., Смирнов В. А., Електрохімічний синтез органічних речовин, Л., 1976; Фістін М. Я., Павлов В. Н., Електроліз в неорганічної хімії, М., 1976; Електрохімія органічних сполук, пров. з англ., М., 1976.
М. Я. Фіошін.




